
肝内胆管癌的体外放射治疗综述
引言
肝内胆管癌(ICC)是继肝细胞癌之后第二常见的原发性肝癌[1]。ICC是一种侵袭性肿瘤,难以治愈,常表现为晚期,因而死亡率高。由于局部疾病进展,引起胆道梗阻,进而导致肝衰竭或胆源性脓毒血症[2]大多数患者在诊断后一年内死亡。
有效的多学科方法是ICC患者获得最佳疗效的最佳策略。对于拟手术患者,治疗性切除是首选的治疗选择。然而,高达70%的患者术后出现局部复发,提示辅助放疗可能有作用,尽管这一作用尚不明确[3]。对于非手术治疗的患者,可考虑先进行全身治疗,然后进行确定性放射治疗等局部治疗。不过,放疗类型多种多样,包括常规、消融性低分割和立体定向体部放射治疗(stereotacticbodyradiationtherapy,SBRT),何时提供何种类型放疗尚不清楚。本综述专注于总结放疗在ICC的辅助和确定性治疗中的作用。相关结果包括总存活率(overall survival,OS)和局部控制率(localcontrol, LC)。我们根据综述须知撰写了本文(参见http://dx.doi.org/10.21037/dmr-20-158)。
方法
我们在MEDLINE/PubMed和ClinicalTrials.gov数据库里进行了系统性检索,重点是近20年的文献。检索词为“肝内胆管癌放射治疗”,仅限于临床试验、荟萃分析和回顾性研究,剔除书籍、文件和综述,最终检索到55篇参考文献。经过人工审查,仅得到2002~2018年的20份合用的参考文献,包括2项进行中的临床试验、1项III期临床试验、5项II期临床试验和12项回顾性研究。绝大部分为ICC患者,部分研究也纳入了肝外胆管癌(ECC)、胆囊癌和HCC。本综述的大部分解释来自于仅关注ICC的研究,前瞻性试验优先,其次是回顾性研究。对于一些混合人群的研究,则用ICC队列来解释结果。如果混合人群无法分离,我们将结合其他已发表的相关主题的报告来解释其结果。
讨论
ICC切除术后的辅助放疗
根治ICC的方法是完全切除受影响的肝段或肝叶。有几项研究探讨了ICC切除术后存活率的影响因素。对70例患者进行的一项回顾性分析,确定残余肿瘤状态和病理分化程度是预测存活率的独立因素[4]。另一项包含224例患者的回顾性研究发现,肝胆管结石、胆管周围浸润性或胆管周围浸润性伴肿块形成、较高T期和更晚期的患者,在肝切除术后往往切缘阳性率较高[5]。肝实质是阳性切缘最常见的部位,其次是胆管和软组织。局部复发是最常见的复发模式,意味着放疗可以改善局部控制效果。
一项对监测、流行病学和最终结果(Surveillance, Epidemiology, and End Results,SEER)数据库的综合分析发现,术后加放疗的ICC患者,存活率有所提高[6]。该研究纳入3839名患者,分为4组,一组接受手术+辅助放疗(N=286),一组接受单纯手术(N=948),一组接受单纯辅助放疗(N=396),一组不接受手术及辅助放疗(N=2209)。接受手术+辅助放疗的患者中位存活时间最长,为11个月,而单纯手术仅为6个月,单纯放疗为7个月,未接受任何治疗的为3个月。该研究的局限性在于,无法评估切缘和淋巴结状态。尽管如此,该研究强有力地证明了,符合手术条件的ICC患者中,手术后加辅助放疗效果最好。
另一项研究发现,辅助放疗有益于提高伴有区域淋巴结转移的ICC患者的存活率[7]。这是一项对90例淋巴结阳性患者的回顾性研究,其中24例接受辅助放疗,66例接受观察。辅助放疗的患者接受的中位总剂量为50Gy(范围为34~60Gy),每次2Gy。结果,辅助放疗的患者的OS为19.1个月,而仅观察的患者为9.5个月。多变量分析显示,年龄增长、多发性肝内原发肿瘤、较高的CA19-9水平以及非放疗组与预后较差有关。最常见的死亡原因是肝内复发。这项研究表明,对于切除后且淋巴结阳性的ICC患者,应强烈考虑辅助放疗。
一项有争议的研究认为,辅助放疗不能提高切缘阳性、淋巴结阴性ICC患者的存活率。该研究对美国国家癌症数据库(National Cancer Database,NCDB)内2897例早期(T1-T3)ICC患者的回顾分析[8]。倾向评分匹配后评价存活情况,使用Cox回归进行生存分析,考察存活率的预测因子。525例患者接受放疗(255例为R0切除,230例为R1或R2切除,43例切除情况不明)。R1/R2切除、淋巴结阴性的患者中生存率有提高的趋势,(39.5个月比21.1个月)。然而,在一个倾向匹配的队列中,通过Cox回归分析发现,放疗与存活率无关,因而作者推断,放疗不能提供存活益处。这项研究因缺乏关于辐射剂量和时机的信息受到批评,也未说明是否给予辅助药物用于局部控制,以及后期是否缓解。鉴于存在相互冲突的数据,应谨慎解释结果。
另一项NCDB回顾分析显示,辅助治疗对具有某些高危特征的ICC患者的存活率有好处[9]。这项研究纳入2813例患者,其中42.3%接受了辅助治疗。研究发现,切缘阳性、淋巴结阳性和III/IVA期患者接受切除术后辅助治疗,可改善存活率。然而,这项研究未能区分辅助治疗的类型,包括放疗、化疗还是放化疗。这就提出了一个问题:哪种形式的辅助治疗更好。
目前,没有比较不同的ICC辅助治疗的随机化研究数据。值得一提的是,有一项II期试验(SWOGS0809),研究了化疗加放化疗对切除的ECC和胆囊癌的作用[10]。这项研究纳入79例根治性切除术后的ECC(68%)和胆囊癌(32%)患者(R0,N=54;R1,N=25),pT2-4期或N+期或切缘阳性,M0,体力状态0-1。患者接受吉西他滨和卡培他滨辅助治疗4个周期,然后使用卡培他滨进行放化疗。采用三维适形放射治疗(3D-conformal radiotherapy,3D-CRT)技术,区域淋巴管辐射剂量为45Gy,而R0切除的肿瘤床辐射剂量为54Gy,R1切除的肿瘤床辐射剂量为59.4Gy。采用调强放射治疗(intensity-modulatedradiotherapy, IMRT)技术,区域淋巴管辐射剂量为45Gy,分25次使用,而采用同步加速IMRT技术,R0切除的肿瘤床辐射剂量为52.5Gy,R1切除的肿瘤床辐射剂量为55Gy。患者预后良好,2年存活率为65%(R0为67%,R1为60%),中位OS为35个月(R0为34个月,R1为35个月)。局部复发14例,远处复发24例,联合复发9例。3级和4级不良反应发生率分别为52%和11%。最常见的3、4级不良反应为中性粒细胞减少症(44%)、手足综合征(11%)、腹泻(8%)、淋巴细胞减少(8%)和白细胞减少症(6%)。1例死于胃肠道出血。这种联合疗法耐受性良好,疗效良好,为临床医生提供了一个良好的方案,目前正在计划III期试验。
目前,评价切除术后系统性辅助治疗唯一的III期研究是BILCAP试验[11]。447例R0或R1切除术后胆管癌患者(84例ICC)随机接受卡培他滨治疗或接受观察。接受卡培他滨治疗的患者,在意向治疗分析中有改善OS的趋势(51.1个月vs.36.4个月),在预定符合方案分析中有显著改善OS的趋势(53个月vs.36个月)。卡培他滨辅助治疗现在是R0/R1切除的ICC的标准治疗。
有一项正在进行的III期试验(ACTICCA-1),旨在比较根治性切除术后辅助放化疗与辅助化疗的效果[12]。这项研究估计纳入781例胆管癌患者,包括R0或R1切除后的ICC和肌肉浸润性胆囊癌。从广义上讲,患者随机接受吉西他滨和顺铂(实验性)或卡培他滨(阳性对照)。在实验组中,一项嵌入式子研究将R1切除患者随机分为放化疗组(6个周期的吉西他滨和顺铂,随后是卡培他滨+IMRT)或单纯化疗组(8个周期的吉西他滨和顺铂)。在阳性对照组中,一项嵌入式子研究将R1切除患者随机分为放化疗组(6个周期的卡培他滨,随后是卡培他滨+IMRT)或单纯化疗组(8个周期的卡培他滨)。主要终点是无病存活率(disease free survival, DFS),次要终点包括无复发存活率(recurrence freesurvival,RFS)、OS、辅助放化疗的安全性和耐受性、生活质量和疾病复发模式。
综上所述,目前尚缺乏ICC切除术后辅助放疗的1级证据。美国临床肿瘤学会(American Society of ClinicalOncology,ASCO)指南根据BILCAP试验,推荐所有ICC患者接受辅助性卡培他滨治疗,但不确定辅助性放疗对ICC起作用[13]。欧洲肿瘤内科学会(EuropeanSociety of Medical Oncology,ESMO)的指南不太具体,建议多学科团队管理ICC,考虑辅助放疗、化疗或放化疗[14]。美国国家综合癌症网络(NationalComprehensiveCancerNetwork, NCCN)指南基于切缘状态和淋巴结状态,提供了最全面的建议[15]。R0切除的患者可以接受观察、辅助化疗或临床试验。R1切除或淋巴结阳性的患者可接受辅助化疗、化疗后加放化疗、放化疗后加化疗或临床试验。R2切除的患者应视为无法切除,这将在下一节中介绍。总之,ICC的辅助放疗仍处于研究阶段,可考虑用于切缘阳性或淋巴结阳性者。放疗辐射剂量为,引流区域淋巴结45 Gy,肿瘤床(尤其是边缘阳性区域)54~59.4Gy,每次1.8Gy。表1总结了本节中提及的数据。

Full table
无法切除的局部晚期ICC的确定性放疗
对于不能切除的局部晚期ICC患者,中位生存期很差,在2.3到12个月之间[16]。不能切除的原因包括多发性肝内肿瘤、肝脏局部晚期疾病伴大血管侵犯、淋巴结或远处转移[17]。根据ABC-02试验的结果,吉西他滨和顺铂联合治疗是目前晚期患者的一线治疗标准[16]。由于大多数患者最终在原发肿瘤部位治疗失败(ABC-02试验为88.3%)[16],所以在联合化疗后进行局部治疗的愈发重要。患者有多种局部治疗可选择,包括经动脉化疗栓塞术(transarterialchemoembolization,TACE)、经动脉放疗栓塞术(transarterialradioembolization,TARE)、射频消融(radiofrequencyablation, RFA)、肝动脉泵治疗和体外放疗,包括SBRT[18]。本综述仅关注体外放疗。
一项回顾性研究评价了体外放疗在不可切除ICC中的作用[19]。研究纳入84名患者,其中35人接受放疗,49人未接受放疗,放疗的中位剂量为50Gy(范围为30~60Gy)。与未放疗的患者相比,接受放疗的患者OS有所改善(分别为9.5个月vs.5.1个月)。放疗的完全缓解率和部分缓解率分别为8.6%和28.5%。19例伴有黄疸的患者放疗后,完全缓解率为26.8%,部分缓解率为31.6%。该研究表明,体外放疗对不能切除的ICC患者,可改善预后,缓解黄疸症状。但是,它并没有确定不可切除的ICC确定性或消融治疗的辐射剂量。
一项I期研究评估了SBRT治疗HCC和ICC的安全性和有效性[20]。研究纳入41例不能切除的HCC(N=31)、ICC(N=10)患者,辐射中位剂量为36Gy(范围为24~54Gy),分为6组。在SBRT治疗后的前3个月内,未发生放射性肝病或与治疗相关的4/5级毒性反应。HCC和ICC患者的中位OS分别为11.7和15.0个月。作者得出结论,对不能切除的HCC和ICC,六次SBRT是一种安全有效的治疗方法。
一项针对肝脏恶性肿瘤的SBRT单次剂量递增研究试图确定SBRT的最大安全剂量[21]。研究纳入26名患者,共有40个可识别的病灶(HCC,N=2;ICC,N=5;肝转移,N=19)。辐射剂量从18 Gy到最大剂量30 Gy,每次增加4Gy。辐射剂量安全地提升至计划的最大剂量30Gy,期间出现9例急性1级毒性、1例急性2级毒性和2例迟发2级毒性。12个月时肝衰竭的累积风险为23%。该研究的结论是,向原发性或转移性肝脏病灶提供高达30Gy的单次、高剂量SBRT是可行和安全的。
此后,有几项试验评价了SBRT治疗后ICC的OS和局部控制情况。一项对58例胆管癌患者的回顾性分析显示,分3次、中位剂量45Gy放疗后,中位OS为10个月,1年局部控制率为85%,2年局部控制率率为72%[22]。出现的3~4级毒性(9%)有十二指肠/胃溃疡、胆管炎、胃穿孔或胆管狭窄。另一项对34例、42个病灶(ICC,N=31,肝门周围胆管癌,N=11)患者的回顾性分析显示,分3次、中位剂量为30Gy放疗后,中位OS为17个月,中位无进展存活时间为10个月,1年局部控制率为88%,4年局部控制率为79%[23]。出现的3级毒性(12%)有十二指肠溃疡、胆管炎和肝脓肿。另一项对31例患者(ECC,N=25,ICC,N=6)的回顾性分析显示,分5次、中位剂量为40Gy放疗后,中位OS为15.7个月,疾病进展中位时间为16.8个月,1年局部控制率为78%,2年局部控制率为47%[24]。特别的是,所有9例局部复发均发生在高剂量SBRT。3级毒性(16%)未具体说明,但所有出现严重迟发毒性的患者均按5次进行40Gy或更高剂量的放疗。另一项回顾性研究纳入37例、43个病灶(ICC,N=17;ECC,N=26)的患者,根据与危险器官(organ atrisk,OAR)的距离,进行3种消融方案的SBRT治疗。12.5Gy×3组用于接近危险器官的病变,4~5.5Gy×12组用于与危险器官直接接触的病变,7~10Gy×5组优先用于在所有其他情况。中位剂量为45Gy,分3~12次。研究显示,从SBRT开始算起,中位OS为14个月;从确诊算起,中位OS为22个月,中位无进展存活时间为9个月[25]。9%的患者发生3级出血,19%的患者发生3级胆管炎。概括来说,SBRT治疗的ICC患者预后良好,中位OS为10~22个月,1年局部控制率为78%~88%,3级毒性发生率为9%~19%。SBRT治疗方案的示例如图1所示。
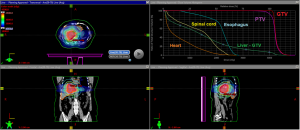
为减少胃肠道和胆道毒性,对于大ICC、中心位置肿瘤(肝门2 cm以内)和病灶邻近关键结构的患者,常规或消融性低分割体外放疗是比SBRT更合适的局部区域治疗方法。一项单臂、II期、多机构研究评估了高剂量低分割质子束放法在无法切除的HCC和ICC中的作用[26]。该研究纳入44例HCC患者和37例ICC患者。HCC和ICC放疗的中位剂量为58Gy,分15次。HCC和ICC的2年局部控制率分别为94.8%和94.1%,2年存活率分别为63.2%和46.5%。这些发现表明,高剂量低分割质子治疗具有良好的局部控制率,支持正在进行的III期试验。
一项回顾性剂量效应分析试图确定改善预后的最佳消融生物等效剂量(biological equivalentdose,BED)截断值[27]。该研究纳入79名ICC患者,分3~30次、以35~100Gy进行治疗,使用同步加速(SIB)技术,其生物等效剂量中位数为80.5Gy(范围为43.75~180Gy)。研究发现,辐射剂量是唯一最重要的预后因素,较高的剂量与改善OS和局部控制率相关。放疗生物等效剂量>80.5 Gy的患者OS和局部控制率优于生物等效剂量≤80.5 Gy的患者(3年存活率为73% vs. 38%,3年局部控制率为78%vs.45%)。治疗耐受性良好,仅有9%的患者出现胆管炎。该研究表明,ICC的任何类型决定性放疗剂量都应达到超过生物等效剂量80.5Gy。
为了评估化疗追加放疗是否影响存活率,NRG-GI001试验将无法手术的局限性ICC患者随机分为两组,吉西他滨+顺铂化疗后,一组接受消融放疗,另一组观察。根据正常组织的限制,处方辐射剂量为67.5、45或37.5Gy,分为15次。然而,这项备受期待的临床试验由于不良反应而提前终止[28]。
总之,对于局部晚期不能切除的ICC患者,标准治疗包括吉西他滨和顺铂联合化疗。如果影像学检查在化疗结束时未发现全身性疾病,则应追加局部治疗。对于多灶性或弥漫性ICC患者,首选动脉导向治疗,如经动脉化疗栓塞术或经动脉放疗栓塞术。否则,应考虑进行体外放疗。对于位于周围的小病变,建议分3~5次进行总剂量30~50 Gy的SBRT治疗。对于大ICC、中心位置肿瘤(肝门2 cm以内)或邻近关键结构的病灶,建议使用三维适形放疗技术进行常规外体外放疗,总剂量可达59.4Gy(分33次),或使用同步增强技术进行IMRT,总剂量55Gy(分25次)[15]。消融性低分割放疗,67.5Gy分15次或75Gy分25次,尚处于探索阶段,只能在有经验的中心进行[27]。表2总结了本节中提及的数据。

Full table
总结
ICC是一种侵袭性疾病,局部复发的几率很高。放疗能改善局部控制,因此在辅助治疗和确定性治疗中都起着重要作用。可手术ICC的根治性疗法是手术切除。如果存在切缘阳性或阳性淋巴结的情况下,需要放疗、化疗、放化疗等辅助治疗。对于局部晚期ICC,吉西他滨和顺铂联合化疗是主要的治疗方法。随后,可对周围小病灶以SBRT的形式进行放疗,或对毗邻关键结构的大肿瘤以常规或低分割方案进行放疗。一如既往,有效的多学科方法为ICC患者长期存活提供最佳机会。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the editorial office, Digestive Medicine Research for the series “Locoregional and systemic treatment in intrahepatic cholangiocarcinoma”. The article has undergone external peer review.
Reporting Checklist: The authors have completed the narrative review checklist. Available at http://dx.doi.org/10.21037/dmr-20-158
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/dmr-20-158). The series “Locoregional and systemic treatment in intrahepatic cholangiocarcinoma” was commissioned by the editorial office without any funding or sponsorship. YJC served as the unpaid Guest Editor of the series and serves as the unpaid editorial board member of Digestive Medicine Research from Mar 2020 to Feb 2022. The authors have no other conflicts of interest to declare.
Ethical statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Shaib Y, El-Serag HB. The epidemiology of cholangiocarcinoma. Semin Liver Dis 2004;24:115-25. [Crossref] [PubMed]
- Patel T. Cholangiocarcinoma-controversies and challenges. Nat Rev Gastroenterol Hepatol 2011;8:189-200. [Crossref] [PubMed]
- Song S, Kim K, Chie EK, et al. Locoregional recurrence after curative intent resection for intrahepatic cholangiocarcinoma: implications for adjuvant radiotherapy. Clin Transl Oncol 2015;17:825-9. [Crossref] [PubMed]
- Murakami Y, Uemura K, Sudo T, et al. Prognostic factors after surgical resection for intrahepatic, hilar, and distal cholangiocarcinoma. Ann Surg Oncol 2011;18:651-8. [Crossref] [PubMed]
- Yeh CN, Hsieh FJ, Chiang KC, et al. Clinical effect of a positive surgical margin after hepatectomy on survival of patients with intrahepatic cholangiocarcinoma. Drug Des Devel Ther 2014;9:163-74. [Crossref] [PubMed]
- Shinohara ET, Mitra N, Guo M, et al. Radiation therapy is associated with improved survival in the adjuvant and definitive treatment of intrahepatic cholangiocarcinoma. Int J Radiat Oncol Biol Phys 2008;72:1495-501. [Crossref] [PubMed]
- Jiang W, Zeng ZC, Tang ZY, et al. Benefit of radiotherapy for 90 patients with resected intrahepatic cholangiocarcinoma and concurrent lymph node metastases. J Cancer Res Clin Oncol 2010;136:1323-31. [Crossref] [PubMed]
- Hammad AY, Berger NG, Eastwood D, et al. Is Radiotherapy Warranted Following Intrahepatic Cholangiocarcinoma Resection? The Impact of Surgical Margins and Lymph Node Status on Survival. Ann Surg Oncol 2016;23:912-920. [Crossref] [PubMed]
- Lee GC, Ferrone CR, Tanabe KK, et al. Predictors of adjuvant treatment and survival in patients with intrahepatic cholangiocarcinoma who undergo resection. Am J Surg 2019;218:959-66. [Crossref] [PubMed]
- Ben-Josef E, Guthrie KA, El-Khoueiry AB, et al. SWOG S0809: A phase II intergroup trial of adjuvant capecitabine and gemcitabine followed by radiotherapy and concurrent capecitabine in extrahepatic cholangiocarcinoma and gallbladder carcinoma. J Clin Oncol 2015;33:2617-22. [Crossref] [PubMed]
- Primrose JN, Fox RP, Palmer DH, et al. Capecitabine compared with observation in resected biliary tract cancer (BILCAP): a randomised, controlled, multicentre, phase 3 study. Lancet Oncol 2019;20:663-73. [Crossref] [PubMed]
- Stein A, Arnold D, Bridgewater J, et al. Adjuvant chemotherapy with gemcitabine and cisplatin compared to observation after curative intent resection of cholangiocarcinoma and muscle invasive gallbladder carcinoma (ACTICCA-1 trial) - a randomized, multidisciplinary, multinational phase III trial. BMC Cancer 2015;15:564. [Crossref] [PubMed]
- Shroff RT, Kennedy EB, Bachini M, et al. Adjuvant therapy for resected biliary tract cancer: ASCO clinical practice guideline. J Clin Oncol 2019;37:1015-27. [Crossref] [PubMed]
- Valle JW, Borbath I, Khan SA, et al. Biliary cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2016;27:v28-v37. [Crossref] [PubMed]
- Gallbladder cancer; intrahepatic cholangiocarcinoma; extrahepatic cholangiocarcinoma. NCCN Guidel Published online 2014:411083. Available online: http://www1.si.mahidol.ac.th/Palliative/node/30
- Valle J, Wasan H, Palmer DH, et al. Cisplatin plus Gemcitabine versus Gemcitabine for Biliary Tract Cancer. N Engl J Med 2010;362:1273-81. [Crossref] [PubMed]
- Endo I, Gonen M, Yopp AC, et al. Intrahepatic cholangiocarcinoma: Rising frequency, improved survival, and determinants of outcome after resection. Ann Surg 2008;248:84-96. [Crossref] [PubMed]
- Maithel SK, Clark Gamblin T, Kamel I, et al. Multidisciplinary approaches to intrahepatic cholangiocarcinoma. Cancer 2013;119:3929-42. [Crossref] [PubMed]
- Chen YX, Zeng ZC, Tang ZY, et al. Determining the role of external beam radiotherapy in unresectable intrahepatic cholangiocarcinoma: A retrospective analysis of 84 patients. BMC Cancer 2010;10:492. [Crossref] [PubMed]
- Tse RV, Hawkins M, Lockwood G, et al. Phase I study of individualized stereotactic body radiotherapy for hepatocellular carcinoma and intrahepatic cholangiocarcinoma. J Clin Oncol 2008;26:657-64. [Crossref] [PubMed]
- Goodman KA, Wiegner EA, Maturen KE, et al. Dose-escalation study of single-fraction stereotactic body radiotherapy for liver malignancies. Int J Radiat Oncol Biol Phys 2010;78:486-93. [Crossref] [PubMed]
- Jung DH, Kim MS, Cho CK, et al. Outcomes of stereotactic body radiotherapy for unresectable primary or recurrent cholangiocarcinoma. Radiat Oncol J 2014;32:163-9. [Crossref] [PubMed]
- Mahadevan A, Dagoglu N, Mancias J, et al. Stereotactic body radiotherapy (SBRT) for intrahepatic and Hilar cholangiocarcinoma. J Cancer 2015;6:1099-104. [Crossref] [PubMed]
- Sandler KA, Veruttipong D, Agopian VG, et al. Stereotactic body radiotherapy (SBRT) for locally advanced extrahepatic and intrahepatic cholangiocarcinoma. Adv Radiat Oncol 2016;1:237-43. [Crossref] [PubMed]
- Gkika E, Hallauer L, Kirste S, et al. Stereotactic body radiotherapy (SBRT) for locally advanced intrahepatic and extrahepatic cholangiocarcinoma. BMC Cancer 2017;17:781. [Crossref] [PubMed]
- Hong TS, Wo JY, Yeap BY, et al. Multi-institutional phase II study of high-dose hypofractionated proton beam therapy in patients with localized, unresectable hepatocellular carcinoma and intrahepatic cholangiocarcinoma. J Clin Oncol 2016;34:460-8. [Crossref] [PubMed]
- Tao R, Krishnan S, Bhosale PR, et al. Ablative radiotherapy doses lead to a substantial prolongation of survival in patients with inoperable intrahepatic cholangiocarcinoma: A retrospective dose response analysis. J Clin Oncol 2016;34:219-26. [Crossref] [PubMed]
- Hong T, Hospital MG, Co-chair MO, et al. Radiation therapy vs. observation following gemcitabine and cisplatin for inoperable localized liver cancer. Available online: https://clinicaltrials.gov/ct2/show/NCT02200042

丁传富
医学硕士,长兴县人民医院。从事肝胆外科专业近3年,近年来专注于胆胰疾病的内镜微创诊疗。熟练肝胆胰外科常见病、多发病的诊治,对肝癌发病机理有深入研究。参与国家课题1项,省级课题1项目,以第一作者发表论文2篇。(更新时间:2021/9/19)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Liu J, Malhotra G, Melstrom L, Chung V, Amini A, Chen YJ. External beam radiation treatment of intrahepatic cholangiocarcinoma: a narrative review. Dig Med Res 2021;4:12.



