胃切除术治疗胃瘫:何时以及如何应用?
胃瘫是一种慢性的胃动力障碍疾病,指无机械性梗阻下的胃排空延迟。典型症状包括恶心、呕吐、腹胀、早饱、餐后饱胀感、上腹痛[1]。该疾病可导致患者衰弱,引起营养不良、体重减轻、电解质紊乱、脱水、生活质量降低[2]。胃瘫最常见的三大病因是糖尿病胃瘫、特发性胃瘫、手术后胃瘫。不论病因如何,组织学显示该疾病存在Cajal间质细胞的减少[3]。
在过去数年里,全美人群中胃瘫的患病率急剧上升。近期的研究估计全美成人中胃瘫的患病率在4%,并且普遍认为病例数在呈上升趋势[4,5]。这已然成为卫生、经济的双重负担。多项研究显示胃瘫相关的住院以及急诊就诊人数大幅增加[5-7]。一项研究显示,在16年间,胃瘫相关入院人数增加了3倍,相关的医疗支出也大幅增加[5]。另一项研究显示,在10年间,胃瘫共产生了35亿美元的住院费用,911963个住院天[6]。对于许多患者而言,胃瘫的症状难以控制,容易复发,且可伴有并发症。
胃瘫的一线治疗是生活方式与饮食调整,对于糖尿病胃瘫,通常包括控制血糖[8]。然而,这些治疗往往作用局限,常常需要进一步的药物或外科手术干预。药物治疗主要是促动力及止吐药,在过去的数十年里未发生明显改变。甲氧氯普胺是目前美国FDA唯一审查并许可用于治疗胃瘫的药物,可使用4-12周,但标有引起迟发性运动障碍的黑框警告[8,9]。其他的药物侧重控制症状,而非解决潜在病因。药物治疗受药物副作用、费用的限制,对一部分患者无效[8-10]。当患者无法耐受药物或药物无法改善症状时,则考虑为药物难治性胃瘫,需探索有创的外科手术方案。虽然有多种术式选择,对于手术方式一直存在争议,尤其是在难治性胃瘫中应用胃切除术。
在本文中,我们综述了难治性胃瘫的外科治疗选择,重点关注其中创伤最大的胃切除术。首先,我们讨论了胃瘫的诊断及检查手段。然后展示了外科手术的治疗策略并回顾了不同的治疗选择。最后,我们深入回顾现有的胃切除治疗难治性胃瘫的文献,试图回答何时以及如何应用这一治疗技术。
诊断及术前检查
胃瘫的诊断金标准是经闪烁扫描客观显示存在胃排空延迟,并伴有相关症状,而不存在机械性梗阻[8]。胃瘫的症状可通过胃瘫主要症状评分指数(gastroparesis cardinal symptom index,GCSI)评估,这一评分工具是由Revicki等开发并验证用于评估胃瘫相关症状的严重程度[11]。包含3个子评分:恶心呕吐、饱腹感及早饱感、腹胀[11]。所有患者术前、术后均需进行GCSI评估,以追踪症状严重程度及治疗反应。
所有患者均需行标准的4h固相胃排空闪烁扫描。4h后放射核素标记的食物胃内滞留率>10%则视为异常[8]。胃瘫的严重程度随4h胃滞留率增加而增加。另一项客观的诊断证据是无线运动胶囊,可测量整个胃肠道的转运时间。该检查有助于区分孤立性胃瘫、合并肠道运动障碍的患者,从而辅助判断预后[8,9]。
此外,所有患者术前应接受胃镜检查。胃镜检查可帮助外科医师了解解剖异常,如是否存在裂孔疝、既往胃底折叠术后复发、幽门狭窄等引起的机械性梗阻、较大的胃石,以上情况可能影响手术方案。特别是对于手术后胃瘫或先前接受过胃底折叠术的患者,应考虑完善胸腹部、盆腔CT以明确解剖。
治疗策略
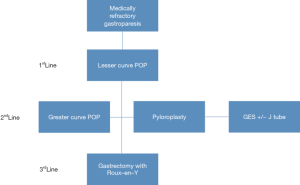
尽管目前还没有难治性胃瘫外科治疗的标准策略,普遍的共识是将胃切除术作为胃保留手术失败后的最终选择。Arthur等近期的一项研究描述了如何使用定制化方案来改善胃瘫症状[12]。图1概述了我们的外科治疗策略。在药物难治性胃瘫的检查及诊断完成后,我们的一线治疗通常是在胃小弯侧行内镜下经口幽门肌切开术(per-oral pyloromyotomy,POP)。若症状缓解失败,我们的二线治疗通常是在大弯侧再次行POP、腹腔镜下幽门成形术(laparoscopic pyloroplasty,LP)、胃电刺激(gastric electrical stimulator,GES)联合或不联合幽门成形术,但需要警告的是,GES目前并未被美国FDA批准用于治疗手术后胃瘫。若胃保留治疗方案失败,我们将胃切除术+Roux-en-Y胃空肠吻合术作为三线治疗和最终的外科方案。
Zihni 等最近提出了类似的治疗策略。在他们的策略里,他们首先评估患者的营养状态。如果患者营养状态非常差,在进行任何外科手术前需进行空肠营养以改善营养状况。他们的一线外科治疗是传统的LP,然而随着POP的发展开始改变。如果一线治疗效果不佳,则建议行GES。以上治疗仍然无效者,将腹腔镜下胃大部切除术作为最后选择[13]。
尽管Zihni 等提出的治疗策略与我们的类似,根据我们的经验以及现有的研究数据,我们通常首先采取POP。在考虑胃切除术前,我们还采取二次幽门肌干预。由于胃切除术治疗这一良性疾病的创伤性,我们建议对难治性胃瘫谨慎采取外科手术治疗。
外科选择
胃瘫的外科治疗方式有多种。胃保留方式包括GES、LP、内镜下POP、肠内营养管置入。外科切除方式包括袖状胃切除术、胃大部切除术、全胃切除术。
胃电刺激
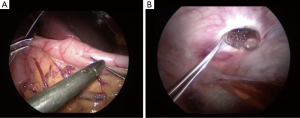
美国FDA于2000年通过了GES装置(Enterra Therapy System, Medtronic, Inc.)人体植入治疗难治性糖尿病胃瘫或特发性胃瘫。操作如图2所示。该设备可开腹或腹腔镜下置入,将2枚导线插入幽门近端9cm、10cm近大弯侧胃前壁的肌层内。然后将脉冲发生器置入皮下囊袋[14]。多项研究探讨了GES的有效性,结果大多是有效的。早期的一项双盲交叉研究显示患者每周呕吐次数及4h胃滞留率显著下降。研究还显示,患者的生命质量提高,术后1年住院天数减少,肠内/肠外营养补充需要减少[15]。随后多个研究证实了以上结果,其中Zoll等的一项系统评价显示恶心改善率45.8%,呕吐改善率49.8%,上腹痛改善率40.6%[14-17]。然而,经验数据还未证明安慰剂以外的治疗作用[15]。该装置最常见的并发症是感染,通常发生在脉冲发生器植入的皮下囊袋,一般需要取出装置。其他并发症包括肠梗阻、胃穿孔、电极脱位或移位[14,16]。
幽门成形术
幽门成形术治疗难治性胃瘫的目标是通过保持幽门通畅从而促进胃排空,同时增加胃流出道的横截面积[13,18]。幽门成形术最常见的是通过腹腔镜Heineke-Mikulicz法完成,沿幽门至十二指肠近端长轴作切口,然后横向缝合。已经相关多的LP治疗难治性胃瘫的研究。Hibbard 等报道了单中心28名接受LP的患者,结果显示术后1月患者促胃动力药物的使用显著降低(89%降至14%, P≤0.0001),71%胃排空时间恢复正常,症状也显著改善[19]。Shada 等人的研究纳入177例胃瘫行LP的患者。研究中未出现术中并发症或转行开腹手术。总体并发症发生率为6.8%,其中4名患者需手术干预,2名患者出现漏。77%的患者胃排空时间恢复正常。10.7%的患者需要再次外科干预,包括GES、空肠造口、胃造瘘、胃大部切除术[20]。总体上,LP是一种安全有效的一线外科治疗技术。
G-POEM
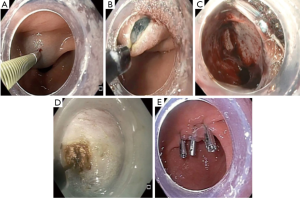
最近,出现了一项POP或被称为G-POEM的创新内镜技术,早期文献显示其具有巨大潜力。POP的步骤如图3所示。建立黏膜下水垫后沿胃小弯侧切开黏膜,建立黏膜下隧道直至幽门并进行分离,完成肌切开。最后用金属夹关闭黏膜切口。若患者之前幽门进行过胃小弯干预,也可以由从大弯侧进行。Khashab等的一项多中心非随机研究比较了POP与药物治疗的安全性及有效性。手术成功率100%,不良事件发生率6.7%。在5.5月的中位随访期内,86%的患者症状完全缓解。复查胃排空扫描的患者中,47%胃排空恢复正常,35%患者改善[21]。还有多项研究也证实了POP的治疗作用 [22-25]。
Landrenau 等最近的一项研究比较了LP与POP的效果。在一项倾向匹配队列研究中,比较了30名分别接受LP或POP的难治性胃瘫患者。两组胃瘫的病因包括特发性、手术后、糖尿病胃瘫。接受LP的患者术后住院天数、手术时间更长、失血量更多,差异均有统计学意义。LP组的并发症更多,包括手术部位感染、肺炎,非计划转入ICU,然而差异并未具有统计学意义。两组患者在GCSI及客观胃排空指标上均显著改善。作者总结虽然两组在功能性结果上类似,POP的围手术期并发症发生率更低,因此用于治疗难治性胃瘫是安全有效的[18]。
胃/空肠营养管
肠内营养可减轻难治性胃瘫的症状,或用于改善患者术前的营养状态。胃造瘘管可以通过内镜轻松置入,用于减压,减轻饱腹、胀气、呕吐症状。不建议将胃造瘘管用于胃瘫患者的营养,因为其可能加重症状。空肠造瘘是肠内营养的首选途径,但无法用于胃减压。空肠造瘘管可以有效绕过胃,保证足够的热量摄入,然而并发症也很常见[14,15]。
袖状胃切除术
袖状胃切除术作为一种难治性胃瘫可能的治疗方式受到越来越多的关注。虽然经验数据稀缺,有多个症状改善的成功案例报道。目前最大的研究来自Lee等,共纳入19例接受袖状胃切除术的难治性胃瘫患者。他们观察到并发症发生率较低,为11%,平均的消化道生活质量评分从术前的78分提高至术后的114分(正常值125)。值得注意的是,在一年以上的随访中,体重指数并未明显变化。3名患者在初次手术1年后症状复发,需要再行标准的胃切除术[26]。尽管这一研究样本量较小,它显示了腹腔镜袖状胃切除术可能在未来成为治疗难治性胃瘫的重要手段。目前,袖状胃切除术仍然是一项试验性治疗技术,在将其作为潜在的一线治疗手段前,仍需要更多数据支持。
胃切除术
对于难治性胃瘫,我们提出的手术治疗策略的最后一步根治性选择是胃大部切除术或全胃切除术。应谨慎选择这一治疗方式,并且只有在其他创伤性较小的手段无法维持较好的治疗效果时才可采用。
手术技术
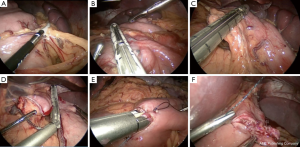
在对难治性胃瘫进行胃切除术时,腹腔镜、机器人微创技术都是合理的,这取决于外科医生接受的培训、经验、医疗资源。此处介绍的技术是微创的胃大部切除术+Roux-en-Y胃空肠吻合术。
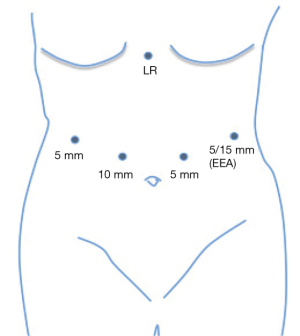
患者采取仰卧位,放置脚板,腹腔镜手术者患者手臂固定成90度,机器人手术者患者手臂收拢于旁侧。术前置入胃管使胃排空。5个10mm的trocar孔呈U形横跨腹部。通常,我们的trocar放置如图4。有可能的话,使用5mm的摄像镜头。如果计划使用EEA吻合器进行食管空肠的环形吻合,左上象限的trocar可以从5mm扩大至15mm。图5展示了我们胃大部切除的基本步骤。我们首先使用弯头双极装置来游离胃大弯,这样可控制止血。分离可在邻近胃壁的地方完成,类似于袖状胃切除时的游离操作。然后选择十二指肠远端的切除部位,通常是幽门稍远端。仔细分离十二指肠下方后,我们通过腹腔镜或机器人线性吻合器横切十二指肠和胃网膜束。与恶性病变行胃切除不同,良性病变行胃切除时,不需要向下切开至胃网膜静脉与肠系膜上静脉的交界处。随后,选择近端切除位置。对于有前肠手术史的患者,我们倾向保留小囊袋或部分胃以及胃左动脉。我们最初的吻合线是沿胃左动脉的降支,通常会加强钉线以处理动脉。一个60mm的吻合器水平于胃击发,另外2个垂直于胃击发以建立囊袋。我们并未常规使用钉线加固。重要的是要清除吻合器附近的杂物以避免吻合失效。然后我们进行空肠-空肠吻合,测量胆胰支为50cm,输出袢为75cm。使用一个60mm的endoGIA吻合器,我们以侧侧吻合的方式进行空肠空肠吻合。一般的肠管切口通过可吸收缝线连续缝合,肠系膜缺损以连续锁式缝合。胃空肠吻合最常为结肠前吻合。我们赞同胃空肠吻合时使用3-0可吸收带倒钩缝线进行手工缝合,将空肠上的吻合点与残胃水平缝合线对齐。在进行胃造口时,胃镜充气有助于提供牵引、反牵引,协助校准吻合口。之后,我们再用勾刀做一个类似大小的空肠造口。吻合口后侧使用3-0可吸收带倒钩缝线进行双层逐层连续缝合。我们常规在吻合口前侧仅进行单层缝合,然而若术中胃镜提示漏,我们通常将使用浆膜肌层叠瓦技术,用2-0编织可吸收缝线加固之前的缝合线。另一种方法是采用吻合器技术进行吻合,使用环形25毫米EEA吻合器或达到所需吻合口直径的线性吻合器(通常为2-4cm)。标本装入标本袋取出,并关闭所有trocar孔。术中是否放置营养管需要根据患者的实际选择。
外科结局
难治性胃瘫中,胃切除术治疗手术后胃瘫的研究最为充分。手术后胃瘫早期主要见于消化性溃疡术后,已有多项研究证实其有效性[27-29]。Eckhauser等研究了81名接受胃大部切除+Roux-en-Y重建治疗手术后胃瘫的患者。未出现死亡或吻合相关并发症。共52名患者完成随访。在平均56个月的随访期内,80%患者症状长期缓解[27]。
最近,Bhayani等报道了一种针对不同病因难治性胃瘫行胃切除术的治疗策略。作者研究了35名难治性胃瘫患者,接受腹腔镜全胃或大部切除,其中34%为糖尿病胃瘫,23%为特发性胃瘫,43%为手术后胃瘫。在中位6个月的随访中,69%恶心减轻或消失(P=0.002),70%慢性腹痛缓解(P=0.3),79%嗳气缓解(P=0.03),89%腹胀缓解(P=0.0005)。研究未出现死亡病例,但漏的发生率为17%,均通过外科手术再干预。作者总结尽管这类复杂人群的手术并发症率较高,但在高手术量的中心,患者可以得到很好的治疗,症状得以改善[30]。
这一微创技术的结果已见诸报道。Landrenau等探索了标准胃切除术与保留胃+Roux-en-Y重建治疗胃瘫[31]。其中26名患者接受了保留胃下的胃囊重建+Roux-en-Y胃空肠吻合,而27名患者接受了标准的胃切除+ Roux-en-Y胃空肠吻合。保留胃组的手术时间更短(155 vs. 223 min, P<0.001),失血量更少(24 vs. 130 mL, P<0.001),住院时间更短(4.0 vs. 7.2 days, P=0.003)。保留胃组30天的并发症发生率也更低(7.7% vs. 44.4%, P=0.001)。然而,该组患者更易接受后续外科手术干预(23.1% vs. 3.7%, P=0.04),其中一例为残胃切除术。两组患者在GCSI上的症状改善类似。虽然保留胃具有诸多优势,我们认为对于难治性胃瘫,标准的胃切除可能更具根治性效果[31]。
外科治疗结局的比较
虽然大多数文献研究了胃切除治疗胃瘫的有效性,仍有一些较大的回顾性研究比较了胃切除与其他微创手术。Zehetner等纳入103名糖尿病胃瘫、特发性、手术后胃瘫的患者,分别接受了GES或腹腔镜胃切除术。总体上,72名患者接受了GES,31名接受了胃切除术。并发症发生率上,胃切除组较GES组更高(23% vs. 8.3%, P=0.06),然而并不具有统计学差异。30天的并发症发生率两组类似(GES 2.7% vs. 胃切除组3%, P=1.00)。值得注意的是,GES组中有13名患者(18%)因症状持续而转行胃大部切除术。在GES组中,67%患者症状改善,而胃切除组则为87% (P=0.02)。所有GES转行胃切除的患者症状均得以改善[32]。类似地,Sun等比较了GES(N=20)与Roux-en-Y胃空肠吻合术(N=7)治疗难治性胃瘫的病态肥胖患者。在GES组,90%初始症状改善,55%在末次随访(平均23个月)时仍保持症状缓解。在Roux-en-Y组,所有患者初始症状改善,71%在末次随访长期改善。GES中,有4名患者需转行胃空肠吻合,并且术后症状都得到缓解[33]。
Zoll等的系统评价比较了难治性胃瘫的三种主要外科治疗技术:GES、幽门干预(包括幽门成形术、幽门肌切开术)、胃切除术。总体上,幽门干预的患者症状改善比例更高,为81.6%,而GES组为69.8%、胃切除组为67.3%。在对特定症状分析时,幽门干预患者恶心的比例低于GES组(P<0.05),幽门干预、胃切除组的呕吐比例低于GES组(P<0.05)。亚组分析显示,幽门成形术、幽门肌切开术的结局类似,胃部分切除与全胃切除类似[17]。
总结
胃瘫是一种复杂的疾病。胃切除术作为最终手段,对于控制症状、改善患者生活质量可能是必须的。然而,这一根治性手术只有在所有保留器官方案失败后才可以考虑。尽管目前对于胃瘫还没有一刀切的治疗策略,我们建议将胃大部切除+Roux-en-Y胃空肠吻合作为难治性胃瘫的根治手段。然而,这一手术理想化地应在高手术量的中心进行,以保障具有足够经验来应用可能发生的较多并发症。另一合理的替代方案是保留胃基础上的Roux-en-Y胃空肠吻合,但应认识到后期可能需要全胃切除。还有一种可选方案是袖状胃切除术,但目前仅有非常有限的经验证据支持这一术式。目前,我们只建议其可在已批准的临床研究中作为难治性胃瘫的治疗方式,从而得到长期数据。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Alfredo Daniel Guerron) for the series “Advanced Laparoscopic Gastric Surgery” published in Digestive Medicine Research. The article has undergone external peer review.
Conflicts of Interest: Both authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/dmr-20-124). The series “Advanced Laparoscopic Gastric Surgery” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Camilleri M, Parkman HP, Shafi MA, et al. Clinical Guideline: Management of Gastroparesis. Am J Gastroenterol 2013;108:18-37. [Crossref] [PubMed]
- Hejazi RA, McCallum RW. Treatment of Refractory Gastroparesis: Gastric and Jejunal Tubes, Botox, Gastric Electrical Stimulation, and Surgery. Gastrointest Endosc Clin N Am 2009;19:73-82. [Crossref] [PubMed]
- Hirsch W, Nee J, Ballou S, et al. Emergency Department Burden of Gastroparesis in the United States, 2006 to 2013. J Clin Gastroenterol 2019;53:109-13. [Crossref] [PubMed]
- Jung HK, Choung RS, Locke GR, et al. The Incidence, Prevalence, and Outcomes of Patients With Gastroparesis in Olmsted County, Minnesota, From 1996 to 2006. Gastroenterology 2009;136:1225-33. [Crossref] [PubMed]
- Wadhwa V, Mehta D, Jobanputra Y, et al. Healthcare utilization and costs associated with gastroparesis. WJG 2017;23:4428. [Crossref] [PubMed]
- Wang YR, Fisher RS, Parkman HP. Gastroparesis-related hospitalizations in the United States: trends, characteristics, and outcomes, 1995-2004. Am J Gastroenterol 2008;103:313-22. [Crossref] [PubMed]
- Grover M, Bernard CE, Pasricha PJ, et al. Clinical-histological associations in gastroparesis: results from the Gastroparesis Clinical Research Consortium: Clinical-histological associations in gastroparesis. Neurogastroenterol Motil 2012;24:531-9. [Crossref] [PubMed]
- Stein B, Everhart KK, Lacy BE. Gastroparesis: A Review of Current Diagnosis and Treatment Options. J Clin Gastroenterol 2015;49:550-8. [Crossref] [PubMed]
- Navas CM, Patel NK, Lacy BE. Gastroparesis: Medical and Therapeutic Advances. Dig Dis Sci 2017;62:2231-40. [Crossref] [PubMed]
- Grover M, Farrugia G. Stanghellini vs. Gastroparesis: a turning point in understanding and treatment. Gut 2019;68:2238-50. [Crossref] [PubMed]
- Revicki DA, Rentz AM, Dubois D, et al. Gastroparesis Cardinal Symptom Index (GCSI): Development and validation of a patient reported assessment of severity of gastroparesis symptoms. Qual Life Res 2004;13:833-44. [Crossref] [PubMed]
- Arthur LE, Slattery L, Richardson W. Tailored approach to gastroparesis significantly improves symptoms. Surg Endosc 2018;32:977-82. [Crossref] [PubMed]
- Zihni AM, Dunst CM, Swanström LL. Surgical Management for Gastroparesis. Gastrointest Endosc Clin N Am 2019;29:85-95. [Crossref] [PubMed]
- Hejazi RA, McCallum RW. Treatment of Refractory Gastroparesis: Gastric and Jejunal Tubes, Botox, Gastric Electrical Stimulation, and Surgery. Gastrointest Endosc Clin N Am 2009;19:73-82. [Crossref] [PubMed]
- Borrazzo EC. Surgical Management of Gastroparesis: Gastrostomy/Jejunostomy Tubes, Gastrectomy, Pyloroplasty, Gastric Electrical Stimulation. J Gastrointest Surg 2013;17:1559-61. [Crossref] [PubMed]
- Abell TL, Bernstein V-RK, Cutts T, et al. Treatment of gastroparesis: a multidisciplinary clinical review. The American Motility Society Task Force on Gastroparesis (members in alphabetical order). Neurogastroenterol Motil 2006;18:263-83. [Crossref] [PubMed]
- Zoll B, Zhao H, Edwards MA, et al. Outcomes of surgical intervention for refractory gastroparesis: a systematic review. J Surg Res 2018;231:263-9. [Crossref] [PubMed]
- Landreneau JP, Strong AT, El-Hayek K, et al. Laparoscopic pyloroplasty versus endoscopic per-oral pyloromyotomy for the treatment of gastroparesis. Surg Endosc 2019;33:773-81. [Crossref] [PubMed]
- Hibbard ML, Dunst CM, Swanström LL. Laparoscopic and Endoscopic Pyloroplasty for Gastroparesis Results in Sustained Symptom Improvement. J Gastrointest Surg 2011;15:1513-9. [Crossref] [PubMed]
- Shada AL, Dunst CM, Pescarus R, et al. Laparoscopic pyloroplasty is a safe and effective first-line surgical therapy for refractory gastroparesis. Surg Endosc 2016;30:1326-32. [Crossref] [PubMed]
- Khashab MA, Ngamruengphong S, Carr-Locke D, et al. Gastric per-oral endoscopic myotomy for refractory gastroparesis: results from the first multicenter study on endoscopic pyloromyotomy (with video). Gastrointest Endosc 2017;85:123-8. [Crossref] [PubMed]
- Strong AT, Rodriguez J, Kroh M, et al. Safety and Feasibility of Per-Oral Pyloromyotomy as Augmentative Therapy after Prior Gastric Electrical Stimulation for Gastroparesis. J Am Coll Surg 2019;229:589-95. [Crossref] [PubMed]
- Strong AT, Landreneau JP, Cline M, et al. Per-Oral Pyloromyotomy (POP) for Medically Refractory Post-Surgical Gastroparesis. J Gastrointest Surg 2019;23:1095-103. [Crossref] [PubMed]
- Khoury T, Mizrahi M, Mahamid M, et al. State of the art review with literature summary on gastric peroral endoscopic pyloromyotomy for gastroparesis: Endoscopic pyloromyotomy in gastroparesis. J Gastroenterol Hepatol 2018;33:1829-33. [Crossref] [PubMed]
- Rodriguez JH, Haskins IN, Strong AT, et al. Per oral endoscopic pyloromyotomy for refractory gastroparesis: initial results from a single institution. Surg Endosc 2017;31:5381-8. [Crossref] [PubMed]
- Lee AM, Fuchs KH, Varga G, et al. Sleeve gastrectomy for treatment of delayed gastric emptying—indications, technique, and results. Langenbecks Arch Surg 2020;405:107-16. [Crossref] [PubMed]
- Eckhauser FE, Conrad M, Knol J, et al. Safety and long-term durability of completion gastrectomy in 81 patients with postsurgical gastroparesis syndrome. Am Surg 1998;64:711-6. [PubMed]
- McCallum RW, Polepalle SC, Schirmer B. Completion gastrectomy for refractory gastroparesis following surgery for peptic ulcer disease: Long-term follow-up with subjective and objective parameters. Digest Dis Sci 1991;36:1556-61. [Crossref] [PubMed]
- Speicher JE, Thirlby RC, Burggraaf J, et al. Results of Completion Gastrectomies in 44 Patients with Postsurgical Gastric Atony. J Gastrointest Surg 2009;13:874-80. [Crossref] [PubMed]
- Bhayani NH, Sharata AM, Dunst CM, et al. End of the Road for a Dysfunctional End Organ: Laparoscopic Gastrectomy for Refractory Gastroparesis. J Gastrointest Surg 2015;19:411-7. [Crossref] [PubMed]
- Landreneau JP, Strong AT, El-Hayek K, et al. Gastrectomy versus stomach left in situ with Roux-en-Y reconstruction for the treatment of gastroparesis. Surg Endosc 2020;34:1847-55. [Crossref] [PubMed]
- Zehetner J, Ravari F, Ayazi S, et al. Minimally invasive surgical approach for the treatment of gastroparesis. Surg Endosc 2013;27:61-6. [Crossref] [PubMed]
- Sun Z, Rodriguez J, McMichael J, et al. Surgical treatment of medically refractory gastroparesis in the morbidly obese. Surg Endosc 2015;29:2683-9. [Crossref] [PubMed]

刘君
本人研究生就读于滨州医学院,专业方向为内科学——消化系病学方向,在研究生学习期间,本人重视医学专业英语的学习,先后顺利取得CET4级、CET6级、医护英语水平考试证书(三级)和医护英语水平考试证书(四级)。能够流利翻译英文专业文献并以第一作者累计发表论文4篇,曾获得“一等奖学金”、“校级优秀毕业生”等荣誉称号。(更新时间:2021/9/12)

董弢
硕士,住院医师,南京医科大学附属常州二院胃肠病中心,第一作者于Digestive Endoscopy等期刊发表SCI论文10余篇,Digestive Diseases and Sciences审稿人。(更新时间:2021/9/24)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Thelen AE, El-Hayek K. Gastrectomy for gastroparesis: when and how. Dig Med Res 2021;4:13.