活体肝移植中的患者和供体选择
介绍
活体供肝移植 (LDLT) 发展的动力是需要肝移植 (LT) 的患者数量与已故供体器官的可用性之间的差距不断扩大。除了复杂的伦理问题外,LDLT 仍然是一个技术要求很高的技术。 然而,自千禧年以来,手术有了显著改善,结果与已故供体肝移植 (DDLT) 的结果相当。 在这些手术中,捐献者的安全和保护肝移植功能的接受者结果一样重要。LDLT 可与其他要求苛刻的程序相媲美,其中团队的承诺和经验与运营的发展和结果密切相关。除了卓越的技术外,严格的捐赠者和接受者的选择标准仍然是获得良好结果的必要条件。本综述概述了 LDLT 中的供体和受体选择标准。
需要 LDLT
在 LT 成为终末期肝病 (ESLD) 的标准治疗方法后不久,很明显,受者人数与可用器官的数量严重不匹配。 供需之间的这种差异导致等候名单上的负担越来越重。 技术的显著扩大导致稀缺供体库的创新,如分裂肝移植,同时有助于 LDLT 的发展 [1]。 除了捐赠者库的简单扩展之外,LDLT 相对于 DDLT 还具有其他一些明显的优点。 这些包括在接受者变得过于不适之前进行选择性 LT 的能力、没有与 DDLT 肝脏相关的不确定性(供体合并症、脑死亡引起的生理紊乱和冷缺血时间)的优质移植物,以及在某些其他情况下对不符合 DDLT 标准纳入标准的患者进行 LT 的可能性。
全球范围内 LDLT 的增长不对称。 由于多种因素,包括缺乏识别和分配死者器官的有组织的系统、广泛接受脑干死亡和死者捐献的文化和宗教障碍以及个体外科手术的存在等多种因素,它深受亚洲国家欢迎[2,3]。 随着已故供体器官的更多可用,西部的 LDLT 需求和数量传统上低于东部。
在其他方面健康的活体捐赠者中,并发症和(或)死亡的有限风险是进行 LDLT 的最大不利因素。 其他缺点包括接受部分肝脏的缺点,这可能导致移植体积不足和伴随的早期移植功能不良。还存在用于吻合的较小血管和多个胆管的额外技术复杂性,以及需要仔细和有条不紊地选择合适的“供体和受体对”以获得最佳结果。
道德考虑
LDLT 的两个基本原则包括确保将捐赠者的发病率和死亡率保持在最低水平,并且接受者的结果不低于全尺寸 DDLT。同样令人清醒地认识到,可能永远不可能证明违反“最重要的是,不要伤害”的核心医学原则的手术是合理的。尽管采取了一切预防措施,即使在最有经验的人手中,捐赠者的死亡也可能是不可避免的 [4-6]。 虽然捐献者死亡的真实发生率可能被低估了,但据称活体肝脏捐献者的死亡风险为 0.15% ~ 0.30%; 当捐赠的肝脏体积更大时,这可能会更高 (0.5%) [5]。
2005 年,一个国际论坛在加拿大温哥华专注于实践原则,旨在确保活体器官捐献者的安全 [7,8]。该论坛制定了一套关于 LDLT 的指导方针,其中包括以下几点:(I) 只有当捐赠者的风险可以通过接受者可接受的结果来平衡时,才应进行 LDLT。 (II) 除了在批准的研究方案场景中,LDLT 的适应症应与为 DDLT 建立的适应症相同。此类适应症的例子包括超出米兰/加州大学旧金山分校标准的肝细胞癌 (HCC),以及新辅助放疗后门静脉癌栓的选定 HCC 病例的 LT [2,9-12]。(III) 通过进行 LDLT 来消除对已故供体器官的等待期应该为受体提供生存益处。因此,在为患者提供 LDLT 之前要考虑的因素包括患者的生活质量、患者肝功能衰竭的严重程度、已故捐赠者的预期等待时间以及接受者的风险与收益比 [13]。
令人振奋的是,肝脏捐赠者的捐赠后生活质量分析表明自尊和满意度有所提高,高达 92% 的捐赠者愿意再次捐赠 [14-17]。 在这方面,一个重要的促成因素是在捐赠者检查期间就手术、并发症和结果进行详细的多阶段咨询,这使这些捐赠者能够对手术有一个现实的看法。 尽管如此,伦理学家无疑将继续辩论活体器官捐赠的风险和益处。
捐助者评估
供体评估旨在揭示可能增加健康供体围手术期并发症风险的条件。这种系统评估应该能够在早期排除不合适的潜在捐赠者,同时允许合适的候选人继续捐赠。
每个活体供体移植计划都需要有自己明确定义的标准和选择移植对的算法过程。这个过程需要透明,患者应该在检查前和检查过程中获得信息。选择合适的捐赠者的做法基于以下原则:(I) 捐赠是真正无私的,不涉及金钱或其他自利动机。(II)捐赠人心智健全,了解风险,具有捐赠知情同意的能力。(III)整个过程是自愿的,没有强迫。同样重要的是,捐赠者要意识到,即使在完成评估后也不会强制进行捐赠,并且捐赠者可以随时撤回同意。 (IV) 捐赠者符合所有规定的医疗适用性标准。
多步骤供体评估协议包括对供体进行详尽的医学和心理评估,以及对肝脏的精确解剖学研究。 全球团队发布的 LDLT 捐助者评估协议非常相似 [18-21]。 尽管肝切除范围与供体风险之间是否存在相关性一直存在争议,但大多数移植团队可能对右叶供体有更严格的标准,尤其是在供体年龄和脂肪变性方面 [21]。 在选择合适的捐赠者时,应始终考虑接受者的身份。 只有在确定接受者是 LT 的合适人选后,才应开始进行捐赠者评估。 正是这种有利和不利特征的组合决定了“移植对”是否适合 LDLT。 以下是我们团队遵循的捐助者评估协议(表1)。

Full table
捐助者选择标准
血型
输血和器官捐赠的血型标准是相似的。因此,AB 型血型的人是万能受血者,O型血型的人是万能献血者。 最好选择 ABO血型相同或 ABO 血型相容的捐赠者。 突破 ABO血型屏障是一种增加个体患者供体机会的方法,在没有合适的 ABO相容的死者或活体供者的情况下,ABO不相容 LT (ABOi LT) 可能是唯一可能挽救生命的选择。在成人中,使用药物、生物制剂、血浆去除术、脾切除术和其他免疫调节疗法的脱敏方案已成功使医生能够跨越血型不相容障碍 [12,22,23]。 随着对移植免疫学和这些优化的免疫抑制方案的更好理解,ABOi LT 的结果现在可与ABO相同的 LT 相媲美 [12,22-24]。 目前,ABOiLT占执行的总LDLT 的5-20%。在 2015 年至2018年期间进行的九项高质量研究中,比较 ABOi LT 与 ABO 相容 (ABOc)LT的最大荟萃分析之一包括总共3,858名患者(ABOi=639 和 ABOc=3,219)[25]。所有 ABOi 患者均采用利妥昔单抗脱敏处理。两组的术后并发症发生率相当。然而,与成人ABOc相比,ABOi LT 的 CMV 感染、抗体介导的排斥 (AMR)、整体胆道并发症和胆道狭窄的发生率更高。尽管如此,与早期研究相比,ABOi 和 ABOc LT 组在 1、3 和 5 年移植物存活率和总存活率方面没有显著差异 [24-26]。
儿科人群拥有优越的免疫系统,这有助于比成人更好地支持 ABOiLT。婴儿不产生同种血凝素,因此,即使超过12个月大,他们的抗A 和 -B 抗体滴度仍保持在低水平。此外,它们的补体系统的激活也相对受到抑制。总之,婴儿具有较少的抗体介导的排斥反应介质。因此,2 岁以下儿童 [27-29] 通常不需要成人 ABOiLT中使用的脱敏方案。
关系
世界上大多数国家当局都规定潜在的捐赠者和接受者是相关的。但是,美国、加拿大、英国、伊朗、沙特阿拉伯、以色列、荷兰、瑞士和香港等某些国家/地区允许匿名无私捐赠 [30-33]。为此目的,任何来自国外的捐赠者都被视为“无关”,即使他/她碰巧是主要的“相关”捐赠者。如果捐赠者和接受者是外国人,则必须从相关大使馆获得有关捐赠者和接受者之间真实关系的许可。
年龄
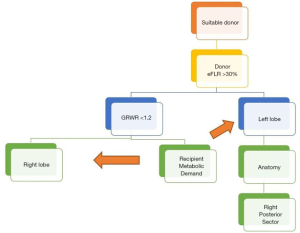
肝再生率对供者和接受者都有明显的影响。由于年龄增长与肝再生率显著下降之间存在相关性,因此年龄仍然是选择潜在供体的关键决定因素 [19,34]。捐赠者的年龄必须严格在 18 岁以上。然而,上限各不相同,并且更多地取决于他们的生理年龄。全球大多数 LDLT 单位使用任意的年龄临界值,不同中心的年龄从50岁到65 岁不等 [35]。还必须考虑移植体积;最好避免来自老年供体的肝脏移植物重量与接受者体重之比(GRWR 表示为 %)过低。尽管有报道称七十多岁的活体捐献者成功捐献了右叶,但在选择老年捐献者时必须非常谨慎,不能作为常规推荐 [36]。
体重和体重指数 (BMI)
理想捐赠者的BMI应低于 25kg/m2。大型队列研究和荟萃分析表明,与正常 BMI 相比,高BMI个体患脂肪肝的风险增加约4至14倍 [37,38]。剂量反应分析还显示风险以非线性方式(近似J 形方式)增加,表明较高的 BMI 是脂肪肝的独立、剂量依赖性风险因素 [37,39]。但是,如果肝脏衰减指数(LAI)估计的脂肪变性程度低于20% 且功能残余量超过35%,则BMI标准可放宽至30kg/m2。多项区域研究表明,在特定 BMI [40-42]下,亚洲人与西方人相比具有更高的体脂百分比。因此,对于亚洲种族的潜在捐赠者,建议采用更严格的BMI临界值 27.5 kg/m[2]。BMI 超过 30kg/m2 通常被认为是生活的相对禁忌症。
尽管如此,在某些情况下,可能会考虑 BMI 较高的捐赠者。一个这样的例子是当一个肌肉非常多的供体的 BMI 被错误地升高时。另一个例子是没有其他合适的供体,并且供体的 BMI 在30到35 kg/m2。为潜在捐赠者提供饮食/锻炼方案,并在 6 周后重新评估以确定捐赠的适合性。理想情况下,捐献前 BMI 应降至30kg/m2以下,并且脂肪变性程度应有显著改善(现在应低于20%)。然而,在减重计划结束时进行肝活检是强制性的。尽管如此,必须牢记BMI并不是脂肪变性的可靠标志。尤其是在南亚人群中,BMI在正常范围内的个体在成像上意外地显示出脂肪肝。该亚组正变得越来越普遍,被诊断为“瘦型非酒精性脂肪性肝病 (NAFLD)”或“非肥胖型 NAFLD” [43-45]。向这些潜在捐赠者提供饮食/锻炼方案,并在6周后通过后续成像重新评估以确定他们是否适合捐赠。
合并症
理想的供体没有任何合并症。由于其对肝脏再生的负面影响,糖尿病仍然是禁忌症。像高血压这样的单一受控合并症可能被认为是可以接受的。其他更严重的合并症,如严重的肾脏或心肺疾病,也被认为是捐赠的禁忌症。 然而,在做出正式决定之前,建议在多学科团队会议上讨论任何潜在捐赠者的合并症。
以前的腹部手术不是捐献的禁忌症。然而,指示可能比操作本身更重要。当需要联合肝肾移植 (CLKT) 时,会出现一个有趣且符合伦理的情况。虽然两次捐赠可能会导致复合发病率,但接受来自同一捐赠者的两个器官可为接受者提供明显的免疫优势。可能出现三种情况,第一种是同时移植两个器官,第二种是先进行 LT,然后在第二次手术中进行肾移植 (KT)。这个顺序手术是在捐赠者从他的肝脏捐赠中恢复后进行的。最罕见的情况是在 KT [46-48] 之后按顺序完成 LT。最小化捐助者风险的基本概念仍然存在,且对任何活体捐赠计划至关重要。肝脏捐赠后的顺序肾脏捐赠,得到了很好的描述。鉴于肝脏在两次捐献之间的滞后时间内已经再生,现在的肾脏捐献者不会增加额外的发病率[12,47,49]。同时还描述了肝肾同时捐赠,尤其是在捐赠了肝脏的左叶/左外侧段时[46,47]。存在右叶肝脏捐献和肾脏捐献的报告,但由于主要肝切除术涉及更高的风险,因此不推荐[48]。还有一份报告称,一位捐赠者在向同一接受者捐赠肾脏 20 年后捐赠了他的肝脏右叶[50]。然而,这种情况与其他情况有很大不同,因为潜在的肝脏捐赠者现在只有一个肾脏,因此存在相关风险。虽然最近的两个系列证明了这种肝脏后肾捐赠的安全性,但必须有严格的捐赠者选择标准来确保捐赠者的安全。在选择这些捐赠者时必须格外小心,并且可以在特殊情况下进行,而不是常规操作[51,52]。
脂肪变性
估计LAI(定义为非增强CT上肝脏和脾脏衰减值之间的差异)是评估脂肪变性程度的一种快速简便的方法。 一个理想的供体应该有小于20%的肝脂肪变性,这与 LAI≥+6 相关。脂肪变性>30% (LAI <-5) 是活体肝脏捐献的禁忌症。对于LAI在这些值之间(LAI-5至+5)的供体,可能需要进行肝活检以更客观地估计脂肪变性。
近年来的技术发展已将非侵入性定性成像技术转变为严格的定量方法。MRI作为细胞内肝脏脂肪测量的定量工具已显示出与组织学分级的良好相关性,并有望在未来提供具有成本效益、可访问且准确的评估 [53,54]。
移植体积
供体肝脏的体积评估需要考虑移植物和残余肝脏的体积。 GRWR通常用于评估肝移植物相对于接受者的充分性。理想的GRWR高0.8。在存在有利供体(例如,年轻、无脂肪变性等)和受体特征(例如,低MELD)的情况下,GRWR较低 (0.7–0.8) 也可以认为是足够的。GRWR<0.7 的移植物通常被认为是不合适的。然而,这些移植物可成功用于高度选择的低 MELD 和轻微门脉高压的患者。这些接受者可能需要门静脉调节以降低小尺寸综合征的风险 [55,56]。
儿童通常需要更大的GRWR 移植物。GRWR在1.5和3 之间的移植物被认为是理想的。如果GRWR 超过4,或者存在显著的尺寸不匹配,则可能需要对非常小的儿童(<6 个月大,<5kg)进行左侧横向切面移植物的解剖或非解剖复位[57]。
虽然GRWR 通常用于西方中心,但日本和香港的 LDLT中心使用基于数学公式的接受者标准肝脏体积 (SLV) 计算来确定足够的移植体积。这些公式通常基于体重或体表面积。大多数中心使用 SLV的30-40%作为肝移植的最低要求[2,20,58]。
解剖适用性
三相CT扫描和MRCP是评估供体肝脏解剖适宜性的最常用方式。应仔细识别可能使捐赠者或接受者手术复杂化的解剖异常(图1-图3)。某些解剖变异,如整个肝脏的单一门静脉供应是捐赠的绝对禁忌症(图2E)。
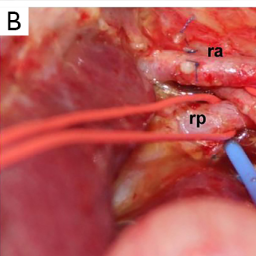
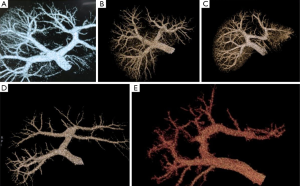
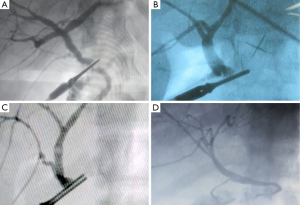
由于V、VIII和IV段的共同引流,LDLT中最大的难题之一是肝中静脉 MHV);它的解剖结构是右叶(RL)活体捐赠的关键。对肝静脉解剖结构的详细研究对于决定 MHV 是与供体肝脏一起留下还是部分或全部与移植肝脏一起带走是必不可少的。虽然在该协议中存在中心到中心的差异,但传统上,MHV 是与RL移植物一起使用的 然而,由于捐赠者的安全至关重要,最近发生了决定性的转变,将 MHV保留给捐赠者。
捐助者评估算法
评估过程的第一阶段从与潜在捐赠者及其家人的详细面谈开始。捐赠者也应该可以选择与医生私下讨论这个过程。这种面对面的咨询包括评估过程的概述和捐赠者的围手术期过程,包括并发症的可能性。采访还讨论了捐赠者的短期和长期成果,旨在提供捐赠的真实情况。接下来是对潜在捐赠者的临床检查,以及最初的一系列血液测试,包括全血细胞计数、肾功能测试、血脂分析、肝功能测试、甲状腺功能测试、免疫和病毒标志物。评估的第一阶段还包括用于肝脏脂肪估计的非对比 CT。建议最初发现由于高 BMI 等可逆原因不合适的捐赠者减肥,并提供锻炼和饮食计划捐助者需要在捐赠前6周戒烟并停止服用避孕药。
第二阶段包括捐赠者的肝脏体积测量和三相CT扫描对解剖结构的评估。基于这些,决定移植物的类型。 影响这一决定的因素包括供体的功能性肝脏残余体积、受体的预期 GRWR 和供体的血管解剖结构(图4)。
所有捐献者都会接受心电图和超声心动图的初步心脏评估。随后的测试包括跑步机测试或多巴酚丁胺压力超声心动图。在这方面,全球各地的协议略有不同。 西部的移植中心根据心电图和超声心动图评估其他方面健康的潜在捐赠者的心脏状态 [59-61]。鉴于上述印度次大陆年轻人群中代谢综合征的高患病率,包括我们在内的中心通常会在心脏评估中添加跑步机测试 [38,41,43-45]。传统的冠状动脉造影和最近的CT冠状动脉造影选择性地在那些在上述任一测试中具有异常结果的潜在捐赠者中进行。合适的捐赠者会接受精神科医生、医师、妇科医生和麻醉师的多学科评估。具体的其他调查是根据具体情况进行的。这是基于在评估过程中标记的任何显著的阳性临床或生化发现。具体的还进行了排除遗传性/家族性肝病的测试,这些疾病可能危及接受者和捐赠者的短期和长期结果(血清铜、铁蛋白、自身免疫标志物等)。应注意排除在某些种族人群中流行的疾病(G6PD中东地区的缺乏症和镰状细胞病非洲捐赠者),因为这些可能会对捐赠者的术中和术后过程产生不利影响。
急性肝衰竭中的快速供体评估
尽管时间很重要,但急性肝衰竭(ALF)的LDLT 供体评估应遵循与其他 LDLT 相同的系统方法。然而,在结合上述几个步骤方面可以做出一些让步。简而言之,在详细的面对面访谈、咨询和初步血液检查之后,所有成像都是同时进行的。然后通过多专业评估快速跟踪潜在捐助者。始终存在一个担忧,即该过程的快速性可能会阻止捐赠者做出谨慎、理性的捐赠决定。捐赠者倡导者始终在捐赠者身边,以帮助他/她完成整个过程,并确保捐赠不会受到胁迫。在这些情况下,必须对心理社会问题进行详细的精神病学评估。目标是在48小时内完成捐赠者评估和批准文件。
常规与选择性肝活检
活体捐献前的常规肝活检仍存在争议。过去,LDLT中心进行常规活检以确定是否存在常规成像未发现的脂肪变性、炎症或纤维化 [13,19,41,62]。然而,肝活检有其自身的一系列并发症,这在其他正常的潜在供体中可能不完全合理。随着可靠的非侵入性肝脏定性评估方法的出现,全球越来越多的中心不再将常规肝脏活检作为供体评估的一部分[53]。在我们的中心,有选择地对BMI超过30kg/m2、血脂异常、存在代谢危险因素或LAI<5以及发现肝酶升高的供体进行肝活检。年长的捐献者或具有上述任何因素的捐献者也接受肝活检。
供者住院及随访
抗生素预防是使用5剂围手术期哌拉西林和他唑巴坦。 在手术室拔管后,捐献者被转移到高依赖性病房,在那里接受连续动脉血气和乳酸测量监测。他们在 HDU 中保留24-48小时,并在术后第5天出院。一个月后他们出院了。在此期间,他们每周都会访问门诊部。移植团队或当地医生对这些捐献者进行长期跟踪,在前6个月每3个月进行一次标准血液检查,然后每年进行一次。
LDLT 接受者评估
与LDLT不同,在DDLT的情况下,器官必须由有组织的系统以公平的方式分配,该分配系统应建立在自治、仁爱、公正和非渎职的原则之上。另一方面,LDLT是定向器官捐赠,需要明确判断以平衡捐赠者风险与接受者利益,满足“双重平衡”的原则[13,19,63]。还必须认识到,随着新数据的出现,LDLT 的适应症也将不断发展。
定义适应症的原则
随着技术的进步和对疾病过程更好的理解,LT的适应症不断被重新审视和修改。但是,定义这些适应症所依据的基本原则一直保持不变 [13,19,64,65]。当没有其他同等有效的替代药物或手术治疗时,向患者提供LT,并且他们在没有移植的情况下的预期寿命可能显著低于 LT后的预期寿命。正如全世界移植医生所接受的那样,接受者移植后至少5年的预期寿命应超过 70%。LT还旨在提高患者的生活质量。一旦列入LT,必须定期对患者进行审查,以确保这些脆弱的患者继续符合列入标准。如果患者病情好转或病情太重而无法从LT中受益,则可能不会为他们提供LT[64,66,67]。除了生活质量差和预期寿命降低外,当存在神经功能障碍、不可逆转的终末器官损伤或肝病导致的生长障碍时,儿童会接受 LT[68,69]。
LT 的广泛适应症
LT 的适应症可大致分为导致慢性肝病的病症和导致急性肝衰竭的病症。再次移植的适应症包括导致早期或晚期移植失败的原因,如肝动脉血栓形成、慢性排斥或原发疾病复发(表2)。LDLT 的适应症通常来自西方的 DDLT主导系统。这些分配系统中的大多数使用客观评分,如终末期肝病 (MELD)模型,以确保最严重的患者首先得到移植。然而,可能存在某些“例外”,即那些本来没有资格进行早期移植的人会获得更高的分数,这样做是为了给他们的病理提供额外的权重 [67,70-72]。

Full table
由于LDLT捐赠类型的内在差异,在仓促将LDLT的适应症扩展到DDLT领域之前,应始终保持“双重平衡”的伦理问题。重要的是要认识到,许多肝硬化患者,无论病因如何,都可能永远不会发生肝功能失代偿。尽管与一般人群相比,这些患者的预期寿命较短,但仅存在肝硬化并不一定使他们有资格接受LT。终末期肝病 (ESLD)的并发症包括静脉曲张出血、自发性细菌性腹膜炎(SBP)、肾功能不全、顽固性腹水、肝性脑病、体液超负荷和肝肺综合征 (HPS)等。这些并发症的存在会大大降低生存率并证明需要 LT。
LT显著提高了有并发症的ESLD患者的生存率。几个系列研究显示,未接受LT的HPS患者的5年生存率为26%,而同等严重程度的低氧血症患者的5年生存率为76%[64,70,72,73]。肾功能不全仍然是肝硬化预后的重要预测因素,这些患者亚群的死亡风险增加了7 倍。发展为SBP的肝硬化患者的一年生存率为40%,因此即使是一次SBP发作也成为移植的指征[64,66,72-74]。除了顽固性瘙痒等主观症状外,胆汁淤积病理(如原发性胆汁性肝硬化)有客观的评分系统来帮助指导是否需要 LT。
ALF患者没有单独的LDLT列表标准,用于DDLT ALF 列表的那些标准通常是为此目的外推的。通常使用经过验证的标准,如国王学院标准、ALFED 标准和Clichy 标准 [75,76]。除此之外,在将这些脆弱的患者列入 LT时,还存在特定于某些国家/地区的标准(USA-UNOS-status 1、英国分配政策等)。儿童的ALF列表标准更加多样化,通常在2岁以下且INR>4 或3-4级肝性脑病时提供LT[69]。
禁忌症
客观公正的决定势必被认为不向不太可能提供肝脏的人提供肝脏受益于 LT。 不移植的决定是一个非常困难的,且移植医师必须做的。 它不仅会影响患者,还会以改变生活的方式影响他们的家人。因此,LT的除名标准和禁忌症与适应症一样重要。根据当地的专业知识和舒适度,它们往往是动态的,并且可能因中心而异。
多年来,定义 LT 禁忌症的某些一般原则一直保持不变 [19,65-67,70]。 这些包括生理状况不佳且不太可能耐受手术的患者(晚期肺部或心脏疾病)、存在活动性败血症以及 LT 后可能的生活质量不佳。 不应向患有转移性疾病的患者提供 LT,因为 LT 后的生存可能无法证明手术风险的合理性。 LT 的另一个绝对禁忌症是接受者行使自主权拒绝手术。 手术团队有时可能认为手术在技术上不可行(例如,广泛的静脉血栓形成); 然而,这些禁忌症取决于团队的专业知识,并且可能因中心而异。
目前,被认为是LT绝对禁忌症的客观标准包括近期心肌梗死、严重肺动脉高压[平均肺动脉压(MPAP)>50 mmHg]、呼吸机依赖和ARDS等。随着这个相对新兴的医学领域的数据不断涌现,禁忌症的动态清单可能会迅速缩小。相对禁忌症列表的变化反映了这一趋势,其中一些包括高龄、HIV、既往接受过治疗的肝外恶性肿瘤和中度肺动脉高压 [19,65-67,70,77,78](表2)。
结论
LT后的存活率逐渐提高。这导致LT适应症的扩大,反映了进展在我们对各种疾病过程的理解和能力方面。 LDLT的最终目标是使活体捐献者的发病率非常低,死亡率接近于零,同时为最需要的人提供生存福利。“理想的LT幸存者”是具有稳定的第一次同种异体移植功能、正常生长且没有免疫抑制相关并发症的人,这是每个临床医生都在努力的目标。实现这一非乌托邦式目标的第一步是通过基于算法协议的多学科方法来选择捐赠者和接受者。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (Drs. Giuliano Testa, Greg McKenna, Johanna Bayer) for the series “Living Donor Liver Transplantation” published in Digestive Medicine Research. The article has undergone external peer review.
Peer Review File: Available at http://dx.doi.org/10.21037/dmr-20-83
Conflicts of Interest: Both authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/dmr-20-83). The series “Living Donor Liver Transplantation” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Broelsch CE, Emond JC, Whitington PF, et al. Application of reduced-size liver transplants as split grafts, auxiliary orthotopic grafts, and living related segmental transplants. Ann Surg 1990;212:368-75. [Crossref] [PubMed]
- Chen CL, Cheng YF, Yu CY, et al. Living donor liver transplantation: the Asian perspective. Transplantation 2014;97:S3. [Crossref] [PubMed]
- Lee SG. Asian contribution to living donor liver transplantation. J Gastroenterol Hepatol 2006;21:572-4. [Crossref] [PubMed]
- Reddy MS, Narasimhan G, Cherian PT, Rela M. Death of a living liver donor: opening Pandora’s box. Liver Transpl 2013;19:1279-84. [Crossref] [PubMed]
- Ringe B, Strong RW. The dilemma of living liver donor death: to report or not to report? Transplantation 2008;85:790-3. [Crossref] [PubMed]
- Ghobrial RM, Freise CE, Trotter JF, et al. Donor morbidity after living donation for liver transplantation. Gastroenterology 2008;135:468-76. [Crossref] [PubMed]
- Pruett TL, Tibell A, Alabdulkareem A, et al. The ethics statement of the Vancouver Forum on the live lung, liver, pancreas, and intestine donor. Transplantation 2006;81:1386-7. [Crossref] [PubMed]
- Barr ML, Belghiti J, Villamil FG, et al. A report of the Vancouver Forum on the care of the live organ donor: lung, liver, pancreas, and intestine data and medical guidelines. Transplantation 2006;81:1373-85. [Crossref] [PubMed]
- Sugawara Y, Inomata Y. Indications for living donor liver transplantation in patients with hepatocellular carcinoma. HepatoBiliary Surg Nutr 2016;5:429-32. [Crossref] [PubMed]
- Soin AS, Bhangui P, Kataria T, et al. Experience With LDLT in Patients with Hepatocellular Carcinoma and Portal Vein Tumor Thrombosis Postdownstaging. Transplantation 2020;104:2334-45. [Crossref] [PubMed]
- Choi HJ, Kim DG, Na GH, et al. The clinical outcomes of patients with portal vein tumor thrombi after living donor liver transplantation. Liver Transpl 2017;23:1023-31. [Crossref] [PubMed]
- Chen CL, Kabiling CS, Concejero AM. Why does living donor liver transplantation flourish in Asia? Nat Rev Gastroenterol Hepatol 2013;10:746-51. [Crossref] [PubMed]
- Miller CM. Ethical dimensions of living donation: experience with living liver donation. Transplant Rev (Orlando) 2008;22:206-9. [Crossref] [PubMed]
- Butt Z, Dew MA, Liu Q, et al. Psychological Outcomes of Living Liver Donors From a Multicenter Prospective Study: Results From the Adult-to-Adult Living Donor Liver Transplantation Cohort Study2 (A2ALL-2). Am J Transplant 2017;17:1267-77. [Crossref] [PubMed]
- LaPointe Rudow D, DeLair S, et al. Longterm Impact of Living Liver Donation: A Self-Report of the Donation Experience. Liver Transpl 2019;25:724-33. [Crossref] [PubMed]
- Karliova M, Malagó M, Valentin-Gamazo C, et al. Living-related liver transplantation from the view of the donor: a 1-year follow-up survey. Transplantation 2002;73:1799-804. [Crossref] [PubMed]
- Parikh ND, Ladner D, Abecassis M, et al. Quality of life for donors after living donor liver transplantation: a review of the literature. Liver Transpl 2010;16:1352-8. [Crossref] [PubMed]
- Nadalin S, Bockhorn M, Malagó M, et al. Living donor liver transplantation. HPB (Oxford) 2006;8:10-21. [Crossref] [PubMed]
- Pomfret EA, Pomposelli JJ, Jenkins RL. Live donor liver transplantation. J Hepatol 2001;34:613-24. [Crossref] [PubMed]
- Lee SG. A complete treatment of adult living donor liver transplantation: a review of surgical technique and current challenges to expand indication of patients. Am J Transplant 2015;15:17-38. [Crossref] [PubMed]
- Rammohan A, Reddy MS, Narasimhan G, et al. Live Liver Donors: Is Right Still Right? World J Surg 2020;44:2385-93. [Crossref] [PubMed]
- Lee J, Lee JG, Lee JJ, et al. Results of ABO-incompatible liver transplantation using a simplified protocol at a single institution. Transplant Proc 2015;47:723-6. [Crossref] [PubMed]
- Song GW, Lee SG, Hwang S, et al. ABO-Incompatible Adult Living Donor Liver Transplantation Under the Desensitization Protocol With Rituximab. Am J Transplant 2016;16:157-70. [Crossref] [PubMed]
- Lee EC, Kim SH, Park SJ. Outcomes after liver transplantation in accordance with ABO compatibility: A systematic review and meta-analysis. World J Gastroenterol 2017;23:6516-33. [Crossref] [PubMed]
- Yadav DK, Hua YF, Bai X, et al. ABO-incompatible adult living donor liver transplantation in the era of rituximab: A systematic review and meta-analysis. Gastroenterol Res Pract 2019;2019:8589402. [Crossref] [PubMed]
- Wu J, Ye SY, Xu XF, et al. Recipient outcomes after ABO-incompatible liver transplantation: A systematic review and meta-analysis. PLoS One 2011;6:e16521. [Crossref] [PubMed]
- Honda M, Sugawara Y, Kadohisa M, et al. Long-term Outcomes of ABO-incompatible Pediatric Living Donor Liver Transplantation. Transplantation 2018;102:1702-9. [Crossref] [PubMed]
- Okada N, Sanada Y, Hirata Y, et al. The impact of rituximab in ABO-incompatible pediatric living donor liver transplantation: the experience of a single center. Pediatr Transplant 2015;19:279-86. [Crossref] [PubMed]
- Narumoto S, Sakamoto S, Sasaki K, et al. ABO-incompatible liver transplantation for children under 2 years of age: A case report and a single-center review. Pediatr Transplant 2019;23:e13308. [Crossref] [PubMed]
- Reichman TW, Fox A, Adcock L, et al. Anonymous living liver donation: Donor profiles and outcomes. Am J Transplant 2010;10:2099-104. [Crossref] [PubMed]
- Duvoux C. Anonymous living donation in liver transplantation: Squaring the circle or condemned to vanish? J Hepatol 2019;71:864-6. [Crossref] [PubMed]
- Goldaracena N, Jung J, Aravinthan AD, et al. Donor outcomes in anonymous live liver donation. J Hepatol 2019;71:951-9. [Crossref] [PubMed]
- Raza MH, Aziz H, Kaur N, et al. Global experience and perspective on anonymous nondirected live donation in living donor liver transplantation. Clin Transplant 2020;34:e13836. [Crossref] [PubMed]
- Durand F, Levitsky J, Cauchy F, et al. Age and liver transplantation. J Hepatol 2019;70:745-58. [Crossref] [PubMed]
- Soin AS, Chaudhary RJ, Pahari H, et al. A Worldwide Survey of Live Liver Donor Selection Policies at 24 Centers With a Combined Experience of 19 009 Adult Living Donor Liver Transplants. Transplantation 2019;103:e39-47. [Crossref] [PubMed]
- Kim SH, Kim YK, Lee SD, et al. Successful living donor liver transplantation between septuagenarians. Am J Transplant 2015;15:274-7. [Crossref] [PubMed]
- Younossi ZM, Koenig AB, Abdelatif D, et al. Global epidemiology of nonalcoholic fatty liver disease—Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology 2016;64:73-84. [Crossref] [PubMed]
- Younossi Z, Anstee QM, Marietti M, et al. Global burden of NAFLD and NASH: Trends, predictions, risk factors and prevention. Vol. 15, Nature Reviews Gastroenterology and Hepatology. Nat Rev Gastroenterol Hepatol 2018;15:11-20. [Crossref] [PubMed]
- Fan R, Wang J, Du J. Association between body mass index and fatty liver risk: A dose-response analysis. Sci Rep 2018;8:15273. [Crossref] [PubMed]
- Singh SP, Sikri G, Garg MK. Body Mass Index and Obesity : Tailoring “cut-off” for an Asian Indian Male Population. Med J Armed Forces India 2008;64:350-3. [Crossref] [PubMed]
- Narasimhan G, Safwan M, Kota V, et al. Donor Outcomes in Living Donor Liver Transplantation-Analysis of 275 Donors From a Single Centre in India. Transplantation 2016;100:1251-6. [Crossref] [PubMed]
- Expert Consultation WHO. Appropriate body-mass index for Asian populations and its implications for policy and intervention strategies. Lancet 2004;363:157-63. [Crossref] [PubMed]
- Das K, Das K, Mukherjee PS, et al. Nonobese population in a developing country has a high prevalence of nonalcoholic fatty liver and significant liver disease. Hepatology 2010;51:1593-602. [Crossref] [PubMed]
- Deurenberg-Yap M, Schmidt G, Van Staveren WA, et al. The paradox of low body mass index and high body fat percentage among Chinese, Malays and Indians in Singapore. Int J Obes Relat Metab Disord 2000;24:1011-7. [Crossref] [PubMed]
- Albhaisi S, Chowdhury A, Sanyal AJ. Non-alcoholic fatty liver disease in lean individuals. JHEP Rep 2019;1:329-41. [Crossref] [PubMed]
- Astarcioglu I, Karademir S, Gülay H, Bora S, Astarcioglu H, Kavukcu S, et al. Primary hyperoxaluria: Simultaneous combined liver and kidney transplantation from a living related donor. Liver Transpl 2003;9:433-6. [Crossref] [PubMed]
- Narasimhan G, Govil S, Rajalingam R, et al. Preserving double equipoise in living donor liver-kidney transplantation for primary hyperoxaluria type 1. Liver Transpl 2015;21:1324-6. [Crossref] [PubMed]
- Marujo WC, Barms MFA, Cury RA, et al. Successful combined kidney-liver right lobe transplant from a living donor. Lancet 1999;353:641. [Crossref] [PubMed]
- Kasahara M, Sakamoto S, Horikawa R, et al. Living donor liver transplantation for pediatric patients with metabolic disorders: the Japanese multicenter registry. Pediatr Transplant 2014;18:6-15. [Crossref] [PubMed]
- Pacheco-Moreira LF, Balbi E, Enne M, et al. One living donor and two donations: Sequential kidney and liver donation with 20-years interval. Transplant Proc 2005;37:4337-8. [Crossref] [PubMed]
- Jackson WE, Kriss MS, Burton JRJ, et al. Reply to “Living liver donation in previous kidney donors: A single-center experience”. Am J Transplant 2021;21:435-7. [Crossref] [PubMed]
- Nair A, Modaresi Esfeh J, Kwon CHD, et al. Living liver donation in previous kidney donors: A single-center experience. Am J Transplant 2020;20:1461-2. [Crossref] [PubMed]
- Caussy C, Reeder SB, Sirlin CB, Loomba R. Noninvasive, Quantitative Assessment of Liver Fat by MRI-PDFF as an Endpoint in NASH Trials. Hepatology 2018;68:763-72. [Crossref] [PubMed]
- Hutton C, Gyngell ML, Milanesi M, et al. Validation of a standardized MRI method for liver fat and T2* quantification. PLoS One 2018;13:e0204175. [Crossref] [PubMed]
- Emond JC, Goodrich NP, Pomposelli JJ, et al. Hepatic Hemodynamics and Portal Flow Modulation: The A2ALL Experience. Transplantation 2017;101:2375-84. [Crossref] [PubMed]
- Rammohan A, Govil S, Rela M. Portosystemic Shunts for “Small for Size Syndrome” Following Liver Transplantation: A Philosopher’s Stone? World J Surg 2017;41:341-2. [Crossref] [PubMed]
- Rammohan A, Gunasekaran V, Reddy MS, et al. Graft reduction in pediatric liver transplantation: The myth of 4? Am J Transplant 2018;18:3081-2. [Crossref] [PubMed]
- Kokudo T, Hasegawa K, Uldry E, et al. A new formula for calculating standard liver volume for living donor liver transplantation without using body weight. J Hepatol 2015;63:848-54. [Crossref] [PubMed]
- Trotter JF, Wisniewski KA, Terrault NA, et al. Outcomes of donor evaluation in adult-to-adult living donor liver transplantation. Hepatology 2007;46:1476-84. [Crossref] [PubMed]
- Nugroho A, Kim OK, Lee KW, et al. Evaluation of donor workups and exclusions in a single-center experience of living donor liver transplantation. Liver Transplant 2017;23:614-24. [Crossref] [PubMed]
- Sharma A, Ashworth A, Behnke M, et al. Donor selection for adult-to-adult living donor liver transplantation: Well begun is half done. Transplantation 2013;95:501-6. [Crossref] [PubMed]
- Chiu KW, Lin TL, Yong CC, et al. Complications of percutaneous liver biopsy in living donor liver transplantation: Two case reports. Medicine (Baltimore) 2018;97:e12742. [Crossref] [PubMed]
- Porret PM, Olthoff KM. Current state of living donor liver transplantation. Clin Liver Dis (Hoboken) 2013;2:160-4. [Crossref] [PubMed]
- Merion RM, Schaubel DE, Dykstra DM, et al. The survival benefit of liver transplantation. Am J Transplant 2005;5:307-13. [Crossref] [PubMed]
- Ahmed A, Keeffe EB. Current Indications and Contraindications for Liver Transplantation. Clin Liver Dis 2007;11:227-47. [Crossref] [PubMed]
- Abdallah MA, Waleed M, Bell MG, et al. Systematic review with meta-analysis: liver transplant provides survival benefit in patients with acute on chronic liver failure. Aliment Pharmacol Ther 2020;52:222-32. [Crossref] [PubMed]
- Hughes CB, Humar A. Liver transplantation: current and future. Abdom Radiol (NY) 2020; Epub ahead of print. [Crossref] [PubMed]
- Rawal N, Yazigi N. Pediatric Liver Transplantation. Pediatr Clin North Am 2017;64:677-84. [Crossref] [PubMed]
- Pham YH, Miloh T. Liver Transplantation in Children. Clin Liver Dis 2018;22:807-21. [Crossref] [PubMed]
- Varma V, Mehta N, Kumaran V, et al. Indications and Contraindications for Liver Transplantation. Guan R, editor. Int J Hepatol 2011;2011:121862.
- Toniutto P, Bitetto D, Fornasiere E, et al. Challenges and future developments in liver transplantation. Minerva Gastroenterol Dietol 2019;65:136-52. [Crossref] [PubMed]
- Artru F, Samuel D. Approaches for patients with very high MELD scores. JHEP reports Innov Hepatol 2019;1:53-65.
- Shiffman ML. Approach to the patient with chronic hepatitis B and decompensated cirrhosis. Liver Int Off J Int Assoc Study Liver 2020;40:22-6. [Crossref] [PubMed]
- Peng Y, Qi X, Guo X. Child-Pugh Versus MELD Score for the Assessment of Prognosis in Liver Cirrhosis: A Systematic Review and Meta-Analysis of Observational Studies. Medicine (Baltimore) 2016;95:e2877. [Crossref] [PubMed]
- Stravitz RT, Lee WM. Acute liver failure. Lancet 2019;394:869-81. [Crossref] [PubMed]
- Squires JE, McKiernan P, Squires RH. Acute Liver Failure: An Update. Clin Liver Dis 2018;22:773-805. [Crossref] [PubMed]
- Gringeri E, Gambato M, Sapisochin G, et al. Cholangiocarcinoma as an Indication for Liver Transplantation in the Era of Transplant Oncology. J Clin Med 2020;9:1353. [Crossref] [PubMed]
- Chu KK, Wong KH, Chok KS. Expanding Indications for Liver Transplant: Tumor and Patient Factors. Gut Liver 2020; Epub ahead of print. [Crossref] [PubMed]

丁传富
医学硕士,长兴县人民医院。从事肝胆外科专业近3年,近年来专注于胆胰疾病的内镜微创诊疗。熟练肝胆胰外科常见病、多发病的诊治,对肝癌发病机理有深入研究。参与国家课题1项,省级课题1项目,以第一作者发表论文2篇。(更新时间:2021/9/2)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Rela M, Rammohan A. Patient and donor selection in living donor liver transplantation. Dig Med Res 2020;3:63.